 (AGENPARL) - Roma, 18 Febbraio 2024
(AGENPARL) - Roma, 18 Febbraio 2024[lid] Elicio, spin-out del MIT, ha sviluppato un vaccino basato su un approccio mirato ai linfonodi sviluppato per la prima volta presso il Koch Institute. I risultati degli studi clinici di fase 1 sui tumori solidi sono finora promettenti.
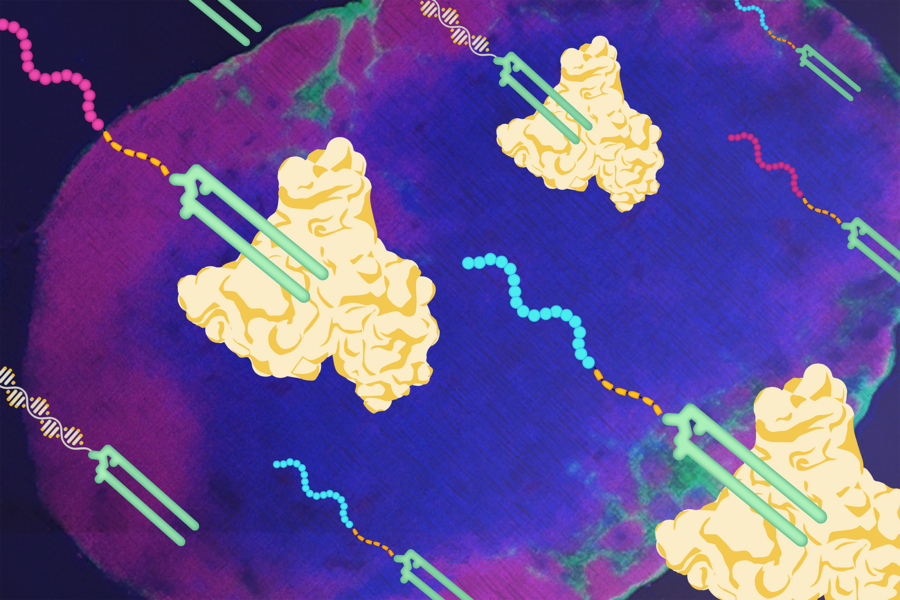
Sviluppati originariamente nel laboratorio di Darrell Irvine, i vaccini “anfifili” fanno l’autostop sulle molecole di albumina fino ai linfonodi, dove insegnano al sistema immunitario a combattere il cancro. Elicio Therapeutics, spin-out del MIT, sta testando vaccini basati su questa tecnologia in studi clinici, con risultati iniziali promettenti nel trattamento del cancro al pancreas.
Crediti:Bendta Schroeder
I vaccini terapeutici contro il cancro rappresentano una strategia interessante per il trattamento delle neoplasie. In teoria, quando a un paziente vengono iniettati antigeni peptidici – frammenti proteici di proteine ??mutanti espresse solo dalle cellule tumorali – le cellule T imparano a riconoscere e attaccare le cellule tumorali che esprimono la proteina corrispondente. Insegnando al sistema immunitario del paziente ad attaccare le cellule tumorali, questi vaccini idealmente non solo eliminerebbero i tumori ma ne impedirebbero la recidiva.
In pratica, tuttavia, nonostante decenni di ricerca, non si sono ancora concretizzati vaccini antitumorali efficaci.
“C’è stato molto lavoro per rendere i vaccini contro il cancro più efficaci”, afferma Darrell Irvine, professore nei dipartimenti di ingegneria biologica e scienza e ingegneria dei materiali del MIT e membro del Koch Institute for Integrative Cancer Research al MIT. “Ma anche nei topi e in altri modelli, in genere provocano solo una risposta immunitaria debole. E una volta che questi vaccini vengono testati in un contesto clinico, la loro efficacia evapora”.
Una nuova speranza potrebbe ora essere all’orizzonte. Un vaccino basato su un nuovo approccio sviluppato da Irvine e colleghi del MIT e perfezionato dai ricercatori di Elicio Therapeutics , una spin-out del MIT fondata da Irvine per tradurre gli esperimenti in trattamenti, sta mostrando risultati promettenti negli studi clinici, compresi i dati di Fase 1 che suggeriscono il vaccino potrebbe servire come una valida opzione per il trattamento del cancro del pancreas e di altri tumori.
Formulare una domanda
Quando Haipeng Liu si unì al laboratorio di Irvine come postdoc quasi 15 anni fa, voleva approfondire il problema del perché i vaccini contro il cancro non sono riusciti a mantenere le loro promesse. Ha scoperto che una ragione importante per cui i vaccini peptidici contro il cancro e altre malattie tendono a non suscitare una forte risposta immunitaria è perché non viaggiano in quantità sufficienti verso i linfonodi, dove sono concentrate le popolazioni di cellule T insegnabili. Sapeva che i tentativi di indirizzare i peptidi ai linfonodi erano stati imprecisi: anche se somministrati con nanoparticelle o attaccati ad anticorpi per le cellule immunitarie linfatiche, troppi peptidi vaccinali venivano assorbiti dalle cellule sbagliate nei tessuti o non arrivavano mai al sistema immunitario. linfonodi.
Ma Liu, ora professore associato di ingegneria chimica e scienza dei materiali alla Wayne State University, aveva anche una domanda semplice e senza risposta: se i peptidi del vaccino non arrivavano ai linfonodi, dove andavano?
Nella ricerca di una risposta, Liu e i suoi colleghi dell’Irvine Lab avrebbero fatto scoperte cruciali per il traffico di peptidi verso i linfonodi e per sviluppare un vaccino che provocasse risposte immunitarie sorprendentemente forti nei topi. Quel vaccino, ora nelle mani della spin-out Elicio Therapeutics, Inc. dell’Irvine Lab, ha prodotto i primi risultati clinici che mostrano una risposta immunitaria altrettanto forte nei pazienti umani.
Liu ha iniziato testando i vaccini peptidici in modelli murini, scoprendo che i peptidi iniettati nella pelle o nei muscoli generalmente penetrano rapidamente nel flusso sanguigno, dove vengono diluiti e degradati anziché viaggiare verso i linfonodi. Ha provato ad aumentare la massa e a proteggere il vaccino peptidico racchiudendolo all’interno di una nanoparticella micellare. Questo tipo di nanoparticelle è composto da molecole “anfifiliche”, con teste idrofile che, in una soluzione a base acquosa, racchiudono un carico utile attaccato alle sue code lipidiche idrofobiche. Liu ha testato due versioni, una che bloccava insieme le molecole micellari per racchiudere in modo sicuro il vaccino peptidico e un’altra, il controllo, che non lo faceva. Nonostante tutta la chimica sofisticata contenuta nelle nanoparticelle micellari bloccate, queste hanno indotto una debole risposta immunitaria. Liu è stato schiacciato.
Irvine, tuttavia, era euforico. Le micelle di controllo debolmente legate hanno prodotto la risposta immunitaria più forte che avesse mai visto. Liu aveva trovato una potenziale soluzione, ma non quella che si aspettava.
Formulazione di un vaccino
Mentre Liu lavorava sulle nanoparticelle micellari, stava anche approfondendo la biologia dei linfonodi. Ha appreso che dopo aver rimosso un tumore, i chirurghi utilizzano un piccolo colorante blu per visualizzare i linfonodi e determinare l’entità delle metastasi. Contrariamente alle aspettative derivanti dal basso peso molecolare della molecola colorante, questa non scompare nel flusso sanguigno dopo la somministrazione. Invece, il colorante si lega all’albumina, la proteina più comune nel sangue e nei fluidi tissutali, e raggiunge in modo affidabile i linfonodi.
Gli anfifili nel gruppo di controllo di Liu si sono comportati in modo simile al colorante per immagini. Una volta iniettate nel tessuto, le micelle “sciolte” venivano divise dall’albumina, che poi trasportava il carico utile del peptide proprio dove doveva andare.
Prendendo come modello il colorante per immagini, il laboratorio ha iniziato a sviluppare un vaccino che utilizzava le code lipidiche per legare le loro catene peptidiche alle molecole di albumina che colpiscono i linfonodi.
Una volta assemblato il loro vaccino autostop con albumina, lo hanno testato su modelli murini di HIV, melanoma e cancro cervicale. Nello studio risultante del 2014 , hanno osservato che i peptidi modificati per legare l’albumina producevano una risposta delle cellule T che era da cinque a dieci volte maggiore della risposta ai soli peptidi.
Nel lavoro successivo, i ricercatori del laboratorio di Irvine sono stati in grado di generare risposte immunitarie ancora più ampie. In uno studio , l’Irvine Lab ha abbinato un vaccino mirato al cancro con la terapia con cellule T CAR. CAR T è stato utilizzato con successo per trattare i tumori del sangue come la leucemia, ma non ha funzionato bene per i tumori solidi, che sopprimono le cellule T nelle loro immediate vicinanze. Il vaccino e la terapia con cellule T CAR insieme hanno aumentato drasticamente le popolazioni di cellule T antitumorali e il numero di cellule T che hanno invaso con successo il tumore. La combinazione ha portato all’eliminazione del 60% dei tumori solidi nei topi, mentre la sola terapia con cellule CAR T non ha avuto quasi alcun effetto.
Un modello per l’impatto sul paziente
Nel 2016, Irvine era pronta per iniziare a tradurre il vaccino dagli esperimenti sui banchi di laboratorio a un trattamento pronto per il paziente, creando una nuova azienda, Elicio.
“Ci siamo assicurati di fissare un livello elevato in laboratorio”, ha affermato Irvine. “Oltre a sfruttare la biologia dell’albumina che è la stessa nei topi e negli esseri umani, abbiamo mirato e ottenuto risposte 10, 30, 40 volte maggiori nel modello animale rispetto ad altri approcci vaccinali gold standard, e questo ci ha fatto sperare che questi risultati si tradurrebbero in una maggiore risposta immunitaria nei pazienti”.
All’Elicio, il vaccino di Irvine si è evoluto in una piattaforma che combina peptidi legati ai lipidi con un adiuvante immunitario: non sono necessarie cellule T CAR. Nel 2021, la società ha avviato una sperimentazione clinica, AMPLIFY-201, di un vaccino denominato ELI-002, mirato ai tumori con mutazioni nel gene KRAS, con particolare attenzione all’adenocarcinoma duttale pancreatico (PDAC). Il vaccino ha il potenziale per soddisfare un bisogno urgente nel trattamento del cancro: il PDAC rappresenta il 90% dei tumori del pancreas, è altamente aggressivo e ha opzioni limitate per un trattamento efficace. Le mutazioni KRAS determinano il 90-95% di tutti i casi di PDAC, ma esistono diverse varianti che devono essere mirate individualmente per un trattamento efficace. Il vaccino antitumorale di Elicio ha il potenziale per colpire fino a sette varianti KRAS contemporaneamente, coprendo l’88% dei casi di PDAC. L’azienda ha inizialmente testato una versione che ne prende di mira due e sono in corso gli studi di fase 1 e 2 della versione che mira a tutti e sette i mutanti KRAS.
I dati pubblicati il ??mese scorso su Nature Medicine relativi allo studio clinico di Fase 1 suggeriscono che un efficace vaccino terapeutico contro il cancro potrebbe essere all’orizzonte. Le solide risposte osservate nei modelli murini dell’Irvine Lab si sono finora tradotte nei 25 pazienti (20 pancreatici, 5 colorettali) coinvolti nello studio: l’84% dei pazienti ha mostrato un aumento medio di 56 volte nel numero di cellule T antitumorali, con eliminazione dei biomarcatori ematici di tumore residuo nel 24%. I pazienti che hanno avuto una forte risposta immunitaria hanno visto una riduzione dell’86% del rischio di progressione del cancro o di morte. Il vaccino è stato ben tollerato dai pazienti, senza effetti collaterali gravi.
“Il motivo per cui mi sono unito a Elicio è stato, in parte, perché mio padre aveva un cancro del colon-retto con mutazione KRAS”, ha affermato Christopher Haqq, vicepresidente esecutivo, capo della ricerca e sviluppo e direttore medico di Elicio. “Il suo viaggio mi ha fatto capire l’enorme bisogno di una nuova terapia per i tumori KRAS-mutati. Mi dà speranza che siamo sulla strada giusta per poter aiutare persone come mio padre e molti altri”.
Nella fase successiva della sperimentazione clinica PDAC, Elicio sta attualmente testando la formulazione del vaccino che mira a sette mutazioni KRAS. L’azienda ha in programma di affrontare altri tumori causati dal KRAS, come i tumori del colon-retto e del polmone non a piccole cellule. Peter DeMuth PhD ’13, ex studente laureato dell’Irvine Lab e ora direttore scientifico dell’Elicio, attribuisce alla cultura della ricerca del Koch Institute il merito di aver plasmato l’evoluzione del vaccino e dell’azienda.
“Il modello adottato dal KI per riunire scienza di base e ingegneria incoraggiando al tempo stesso la collaborazione all’intersezione di discipline complementari è stato fondamentale per plasmare la mia visione dell’innovazione e della passione per la tecnologia in grado di avere un impatto nel mondo reale”, ricorda. “Questo si è rivelato un ecosistema molto speciale per me e molti altri per coltivare una mentalità ingegneristica sviluppando allo stesso tempo una conoscenza interdisciplinare completa di immunologia, chimica applicata e scienza dei materiali. Questi temi sono diventati centrali nel nostro lavoro in Elicio”.
Il finanziamento per la ricerca su cui si basa la piattaforma vaccinale di Elicio è stato fornito, in parte, da una borsa di ricerca quinquennale sul cancro del Koch Institute, dal Marble Center for Cancer Nanomedicine e dal Bridge Project, una partnership tra il Koch Institute for Integrative Cancer Research del MIT e il Dana-Farber/Harvard Cancer Center.
