 (AGENPARL) - Roma, 15 Settembre 2023
(AGENPARL) - Roma, 15 Settembre 2023[lid]
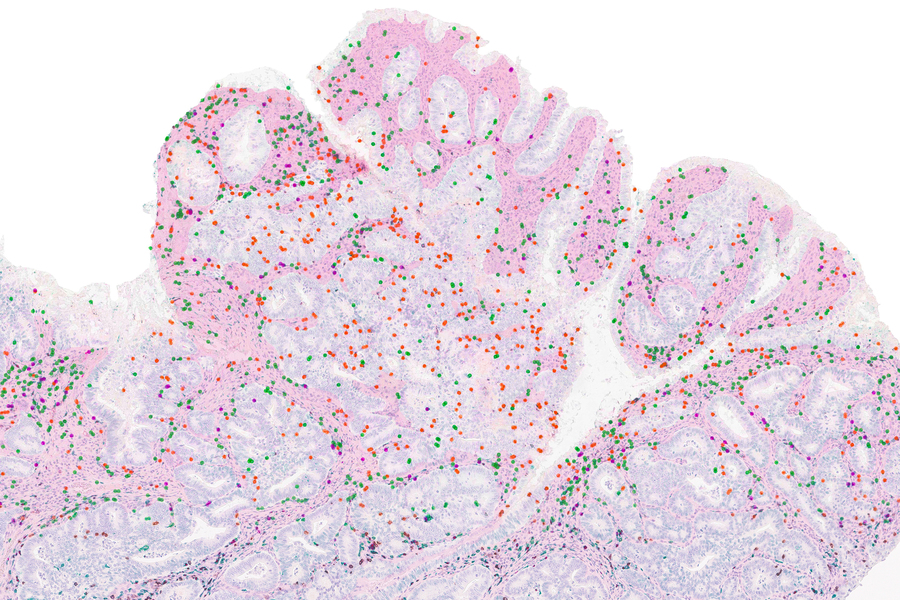
In questo tumore del colon, che presenta una mutazione che gli conferisce un elevato grado di deficit di riparazione del disadattamento del DNA, le cellule T (etichettate in nero, verde e rosso) si sono accumulate principalmente nei tessuti di supporto (regioni rosa), mentre pochissime si sono infiltrate nel tumore. cellule (isole circondate dai tessuti di supporto).
Crediti:Immagine: per gentile concessione dei ricercatori
I risultati potrebbero aiutare i medici a identificare i pazienti affetti da cancro che trarrebbero maggiori benefici dai farmaci chiamati inibitori del blocco del checkpoint.
I farmaci antitumorali noti come inibitori del blocco del checkpoint si sono dimostrati efficaci per alcuni pazienti affetti da cancro. Questi farmaci agiscono frenando la risposta delle cellule T del corpo, stimolando le cellule immunitarie a distruggere i tumori.
Alcuni studi hanno dimostrato che questi farmaci funzionano meglio nei pazienti i cui tumori presentano un numero molto elevato di proteine ??mutate, il che, secondo gli scienziati, è dovuto al fatto che tali proteine ??offrono numerosi bersagli da attaccare per le cellule T. Tuttavia, per almeno il 50% dei pazienti i cui tumori mostrano un elevato carico mutazionale, gli inibitori del blocco del checkpoint non funzionano affatto.
Un nuovo studio del MIT rivela una possibile spiegazione del perché ciò accade. In uno studio sui topi, i ricercatori hanno scoperto che la misurazione della diversità delle mutazioni all’interno di un tumore ha generato previsioni molto più accurate sul successo del trattamento rispetto alla misurazione del numero complessivo di mutazioni.
Se convalidate negli studi clinici, queste informazioni potrebbero aiutare i medici a determinare meglio quali pazienti trarranno beneficio dagli inibitori del blocco dei checkpoint.
“Sebbene siano molto potenti nelle giuste impostazioni, le terapie dei checkpoint immunitari non sono efficaci per tutti i pazienti affetti da cancro. Questo lavoro chiarisce il ruolo dell’eterogeneità genetica nel cancro nel determinare l’efficacia di questi trattamenti”, afferma Tyler Jacks , professore di biologia di David H. Koch e membro del Koch Institute for Cancer Research del MIT.
Jack; Peter Westcott, ex postdoc del MIT nel laboratorio Jacks che ora è assistente professore al Cold Spring Harbor Laboratory; e Isidro Cortes-Ciriano , leader di un gruppo di ricerca presso l’Istituto europeo di bioinformatica dell’EMBL (EMBL-EBI), sono gli autori senior dell’articolo , apparso oggi su Nature Genetics .
Una diversità di mutazioni
In tutti i tipi di cancro, una piccola percentuale di tumori presenta quello che viene chiamato un elevato carico mutazionale tumorale (TMB), il che significa che hanno un numero molto elevato di mutazioni in ciascuna cellula. Un sottoinsieme di questi tumori presenta difetti legati alla riparazione del DNA, più comunemente in un sistema di riparazione noto come riparazione del disadattamento del DNA.
Poiché questi tumori hanno così tante proteine ??mutate, si ritiene che siano buoni candidati per il trattamento immunoterapico, poiché offrono una miriade di potenziali bersagli da attaccare da parte delle cellule T. Negli ultimi anni, la FDA ha approvato un inibitore del blocco del checkpoint chiamato pembrolizumab, che attiva le cellule T bloccando una proteina chiamata PD-1, per trattare diversi tipi di tumori che hanno un TMB elevato.
Tuttavia, studi successivi su pazienti che avevano ricevuto questo farmaco hanno rilevato che più della metà di loro non rispondeva bene o mostrava solo risposte di breve durata, anche se i loro tumori presentavano un elevato carico mutazionale. Il team del MIT ha deciso di esplorare il motivo per cui alcuni pazienti rispondono meglio di altri, progettando modelli murini che imitano da vicino la progressione dei tumori con TMB elevato.
Questi modelli murini portano mutazioni nei geni che guidano lo sviluppo del cancro nel colon e nei polmoni, nonché una mutazione che interrompe il sistema di riparazione del disadattamento del DNA in questi tumori non appena iniziano a svilupparsi. Ciò fa sì che i tumori generino molte mutazioni aggiuntive. Quando i ricercatori hanno trattato questi topi con inibitori del blocco del checkpoint, sono rimasti sorpresi di scoprire che nessuno di loro rispondeva bene al trattamento.
“Abbiamo verificato che stavamo inattivando in modo molto efficiente il percorso di riparazione del DNA, determinando molte mutazioni. I tumori avevano lo stesso aspetto dei tumori umani, ma non erano maggiormente infiltrati dalle cellule T e non rispondevano all’immunoterapia”, afferma Westcott.
I ricercatori hanno scoperto che questa mancanza di risposta sembra essere il risultato di un fenomeno noto come eterogeneità intratumorale. Ciò significa che, sebbene i tumori presentino molte mutazioni, ciascuna cellula del tumore tende ad avere mutazioni diverse rispetto alla maggior parte delle altre cellule. Di conseguenza, ogni singola mutazione del cancro è “subclonale”, nel senso che è espressa in una minoranza di cellule. (Una mutazione “clonale” è quella espressa in tutte le cellule.)
In ulteriori esperimenti, i ricercatori hanno esplorato cosa è successo quando hanno cambiato l’eterogeneità dei tumori polmonari nei topi. Hanno scoperto che nei tumori con mutazioni clonali, gli inibitori del blocco del checkpoint erano molto efficaci. Tuttavia, poiché aumentavano l’eterogeneità mescolando cellule tumorali con diverse mutazioni, hanno scoperto che il trattamento diventava meno efficace.
“Ciò ci mostra che l’eterogeneità intratumorale in realtà confonde la risposta immunitaria e che in realtà si ottengono forti risposte di blocco del checkpoint immunitario solo quando si ha un tumore clonale”, afferma Westcott.
Mancata attivazione
Sembra che questa debole risposta delle cellule T si verifichi perché le cellule T semplicemente non vedono abbastanza proteine ??cancerose, o antigeni, per attivarsi, dicono i ricercatori. Quando i ricercatori hanno impiantato topi con tumori che contenevano livelli subclonali di proteine ??che normalmente inducono una forte risposta immunitaria, le cellule T non sono riuscite a diventare abbastanza potenti da attaccare il tumore.
“Si possono avere queste cellule tumorali potentemente immunogeniche che altrimenti dovrebbero portare a una profonda risposta delle cellule T, ma con questa bassa frazione clonale, diventano completamente invisibili e il sistema immunitario non riesce a riconoscerle”, dice Westcott. “Non c’è abbastanza antigene riconosciuto dalle cellule T, quindi non sono sufficientemente innescate e non acquisiscono la capacità di uccidere le cellule tumorali.”
Per vedere se questi risultati potessero estendersi ai pazienti umani, i ricercatori hanno analizzato i dati di due piccoli studi clinici su persone che erano state trattate con inibitori del blocco dei checkpoint per il cancro del colon-retto o dello stomaco. Dopo aver analizzato le sequenze dei tumori dei pazienti, hanno scoperto che i pazienti con tumori più omogenei rispondevano meglio al trattamento.
“La nostra comprensione del cancro migliora continuamente e questo si traduce in migliori risultati per i pazienti”, afferma Cortes-Ciriano. “I tassi di sopravvivenza dopo una diagnosi di cancro sono migliorati significativamente negli ultimi 20 anni, grazie alla ricerca avanzata e agli studi clinici. Sappiamo che il cancro di ogni paziente è diverso e richiederà un approccio su misura. La medicina personalizzata deve tenere conto delle nuove ricerche che ci aiutano a capire perché i trattamenti contro il cancro funzionano per alcuni pazienti ma non per tutti”.
I risultati suggeriscono anche che trattare i pazienti con farmaci che bloccano il percorso di riparazione del disadattamento del DNA, nella speranza di generare più mutazioni che le cellule T potrebbero colpire, potrebbe non aiutare e potrebbe essere dannoso, dicono i ricercatori. Uno di questi farmaci è ora in fase di sperimentazione clinica.
“Se provi a mutare un cancro esistente, in cui sono già presenti molte cellule tumorali nel sito primario e altre che potrebbero essersi diffuse in tutto il corpo, creerai una raccolta super eterogenea di genomi tumorali. E quello che abbiamo dimostrato è che con questa elevata eterogeneità intratumorale, la risposta delle cellule T è confusa e non c’è assolutamente alcuna risposta alla terapia del checkpoint immunitario”, afferma Westcott.
La ricerca è stata finanziata dal Koch Institute Support (core) Grant del National Cancer Institute degli Stati Uniti, dall’Howard Hughes Medical Institute e dal Damon Runyon Fellowship Award.
